Proliferations-Akkumulations-Tumor-Hypothese (PATH)
Eine neue Hypothese zur Ursache, Entstehung und Heilung von KrebsKrebs als Alterserkrankung
Die Vertreter der Krebs-Multimutationstheorien (2-Hit-Hypothese, Klonale Evolutionstheorie und Tumorstammzellentheorie) argumentieren oft, das ihre Theorien (die sich zum Teil widersprechen) von allen Theorien am besten mit Krebs als Alterskrankheit korrelieren, weil auch Mutationen (=ein ungerichtetes Zufallsereignis) wahrscheinlicher werden, je mehr Zeit vergeht und je mehr karzinogene Noxen einwirken können. Das klingt zwar logisch, ist aber tatsächlich nur die Überbewertung einer nicht existierenden Wahrscheinlichkeit und damit falsch.
Der Zufall ist ein ungerichtetes, unbestimmtes Einzelereignis, dass in der Realität nicht von äußeren Entitäten wie Zeit oder Anzahl der Versuche beeinflusst wird.
Beispiel: Könnte man alle Lottospieler die irgendwann einmal in irgendeinem Lottospiel weltweit den Hauptgewinn gewonnen haben miteinander vergleichen, dann würden man feststellen, dass sich die Dauer und die Häufigkeit mit der sie vor ihrem Hauptgewinn Lotto gespielt haben relativ gleichmäßig verteilt, weil der Zufall von solchen äußeren Faktoren nicht tangiert wird.
Man könnte nun einwenden, dass man wenn man 100 mal würfelt auch häufiger die 6 trifft, als wenn man nur 10 mal würfelt, ergo auch die Wahrscheinlichkeit von Krebsmutationen steigt, wenn über eine lange Zeit viele Karzinogene einwirken. Dies trifft aber nur bei geringen Zahlenwerten zu. Statt dessen gilt:
Ist die Differenz zwischen Ereignisraum und Anzahl der gültigen Ereignisse um ein vielfaches größer als die innerhalb eines realen Zeitraums mögliche Anzahl an Versuchen, dann ist der Einfluss von Zeit und Anzahl der Versuche auf die Wahrscheinlichkeit völlig irrelevant.
Beispiel: Wenn sie 1 Lottoreihe spielen bei 6 aus 49 haben sie eine Chance von 1:140.000.000 bzw. p=0.000000007. Spielen sie 1000 Lottoreihen, dann liegt ihre Trefferwahrscheinlichkeit bei 1000:140.000.000 bzw. p=0.000007. Aber in beiden Fällen ist ihre Chance auf den Hauptgewinn gleich Null.
Aus diesem Grund ist die Aussage, dass Krebs wahrscheinlicher wird, je mehr Zeit vergeht oder je mehr Karzinogene oder Teilchen einwirken, mathematisch unhaltbar. Tatsächlich gilt:
Wäre Krebs eine Mutationserkrankungen, müsste sich die Krebs auf die diversen Lebensalter relativ gleichmäßig verteilen. Und wäre dennoch extrem selten.
Denn Mutationen sind ein seltenes, ungerichtetes Ereignis. Und Mutationen die auch noch genau die Gene betreffen, die Krebs auslösen könnten, sind noch seltener und unwahrscheinlicher. Die Wahrscheinlichkeit für z. B. 3 Krebs-Mutationen in einer Zelle, liegt bei bestenfalls 1:1034. Um sich klar zu machen, was dies bedeutet: Wenn Sie jetzt vor die Tür treten und gerade der Mann vom Lotto auf Sie zukommt, um Ihnen mitzuteilen, dass Sie den Hauptgewinn gezogen haben und Sie im gleichen Moment bei klaren Himmel vom Blitz getroffen werden, dann ist das mehrere Billionen mal wahrscheinlicher als 3 Krebsmutationen.
Die Krebs-Multimutationstheorien
Die Mathematik und Logik sind nicht die einzigen Probleme der Krebs-Multimutationstheorien. Tatsächlich sprechen fast alle Fakten, wenn man sie den objektiv betrachtet, gegen Hypothesen die auf das Multimutationsprinzip setzen. Die Defizite sind so zahlreich, dass man sie in einem Artikel nur in ganz geringen Umfang anreißen kann.
So sind z. B. alleine schon wegen der DNA-Reparatur und Apoptose, Krebs aufgrund von Mutationen unwahrscheinlich. Diese beiden stets gemeinsam arbeitenden Mechanismen sind einer der Gründe, warum es auch bei mutationsfreudigen Bakterien (Mutation sind überlebenswichtig für Bakterien und sie neigen daher auch häufig zum horizontalen Gentransfer) nur in ca. 1 von 1 Milliarde Fällen zur einer manifesten Mutation kommt (im geschätzten Mittel. Je nach Berechnungsmethode und Studie irgendwo zwischen 1:105 bis 1:1012 oder noch seltener) [4][5][6].
Seit einiger Zeit versuchen die Vertreter der Multimutationstheorien daher mit Schlagworten wie "Versagen der DNA-Reparatur" oder "Fehler bei der DNA-Reparatur", die Effizienz der DNA-Reparatur zu kompromittieren. Doch abgesehen davon, dass dies noch keiner wissenschaftlichen Arbeit bisher überzeugend gelungen ist, wird das Wesentliche übersehen: Der entscheidende Umstand ist nicht die DNA-Reparatur – die versagt auch bei Bakterien in 1:100.000 Fälle – sondern die Apoptose/Nekrose in Verbindung mit dem Zellarrest, also der direkte oder indirekte Tod der Zelle falls die Reparatur nicht gelingt. Dieser Umstand, die Apoptose bzw. Nekrose/Nektroptose ist es, der bei Bakterien nur in einem von einer Milliarden Fällen (und bei Eukaryoten vermutlich noch viel seltener) eine Mutation zulässt. Insofern läuft jeder Versuch die DNA-Reparatur zu kompromittieren letztlich immer ins Leere, solange Apoptose/Zellarrest/Nekrose funktionieren.
Weitere sehr bekannte Defizite der Multimutationstheorien:
1. Mutationen bei Krebszellen liegen i. d. R., wenn überhaupt, dann nur zu 0,01-0,2% aller Fälle auf proteincodierten DNA-Abschnitten. Was bereits ungewöhnlich ist, da 5% der DNA proteincodiert ist und daher vom Prinzip der Wahrscheinlichkeit her auch 5% der Mutationen proteincodierte DNA-Abschnitte betreffen sollte. Dass dies nicht der Fall ist, ist ein Hinweis auf die enorme Effizienz der DNA-Reparatur und vor allem der Apoptose. Und ein Beweis, dass diese Abwehrmechanismen bei proteincodierten DNA-Abschnitten besonders empfindlich reagieren und derartige Mutationen maximal verhindern [7] .
2. Alle Mutationen von Krebszellen in einem Tumor, selbst die Mutationen auf den nicht-proteincodierten DNA-Abschnitten, liegen völlig diffus verteilt und unterscheiden sich innerhalb eines Tumors von Krebszelle zu Krebszelle ohne das ein gemeinsames Mutationsmuster auch nur in Ansätzen erkennbar wäre [8].
Alles in allem muss man daher feststellen:
Das was bei mindestens 50% aller Menschen zu Krebs führt bzw. beim Menschen die zweithäufigste Todesursache darstellt, kann nicht etwas sein, dass erst irgendwann durch einen seltenen, ungerichteten Zufall entstehen muss.
Die Karzinogene
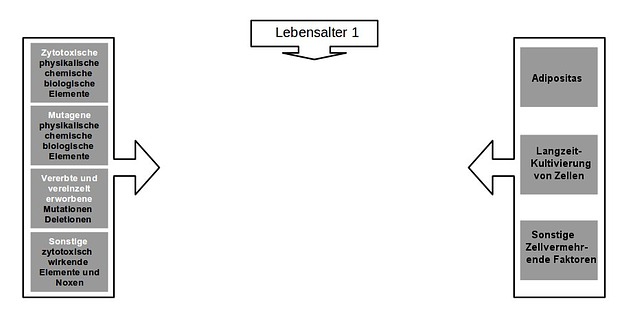
Es existieren Entitäten, Karzinogene genannt, die mit Krebs zeitlich und räumlich korrelieren. Diese lassen sich am einfachsten grafisch zusammenfassen:
Karzinogene grafisch zusammengefasst (Bild: Thomas Wascher)
Eine zeitliche und räumliche Korrelation ist zwar noch kein Beweis für irgendetwas, aber immerhin existiert mit den Karzinogenen ein roter Faden, mit dem wir nach einem oder mehreren Kausalzusammenhängen suchen könnten. Fragt man Vertreter der Multimutationstheorie(n) nach diesem Kausalzusammenhang wird die Antwort lauten, dass alle Karzinogene mutagen wirken oder zu Mutationen führen. Doch genau das ist nicht der Fall:
Die mutagene Wirkung ist, vor allem wenn man weiß, dass auch die mutagene Wirkung in erster Linie eine zytotoxische Wirkung ist, die mit Abstand seltenste Wirkung der Karzinogene.
Oder einfacher ausgedrückt: Karzinogene wirken fast ausschliesslich zytotoxisch und praktisch nie mutagen [9]. Das extremste Beispiel hierfür: "Ionisierende (radioaktive) Strahlung". Heutzutage glaubt jeder, auch fast jeder Wissenschaftler, unwiderlegbar zu wissen, dass ionisierende Strahlung Mutationen hervorruft. Strahlung ist praktisch zu einem Synonym für Mutagenität geworden. Doch tatsächlich ist das so nicht richtig. Denn ionisierende Strahlung wirkt zwar schädigend auf das Erbgut, ist aber vor allem eine physikalische Noxe die an zytotoxischer Wirkung kaum zu übertreffen ist: Das Zytosol verdampft, Filamente lösen sich auf, die Zellhülle reißt und das Zellgerüst bricht in sich zusammen, die Zellmembranen trocknen aus, die Proteine verklumpen und denaturieren, alle Wasserstoffbrücken und auch der Zellkern lösen sich auf und die DNA wird fast auf ganzer Länge zerstört durch unzählige Strangbrüche, von denen jeder einzelne sofort und unmittelbar zur Apoptose führen müsste. All das geschieht meistens zusammen und gleichzeitig. Da bleibt nicht viel übrig, was mutieren könnte. Und genau das ist das Problem von vielen hoch mutagenen Elementen wie z. B. Strahlung:
Mutagene Wirkung muss stets eine subtile, punktuelle Wirkung sein. D. h. mutagene Noxen müssen so fein dosiert wirken, dass sie die Zelle nur genau an einem bestimmten Punkt der DNA schädigen und am besten nirgendwo anders. Damit die Zelle nicht schon mechanisch oder durch Auslösung der Apoptose/Nekrose zerstört wird bevor der Schaden überhaupt zur Mutation (durch weitere Zellteilungen) transformieren kann.
Eine Parabel was damit gemeint ist, macht dies alles vielleicht etwas deutlicher: Stellen Sie sich vor, Sie besitzen eine fein gearbeitete Rolex und stellen eines Tages fest, dass diese um eine Sekunde nach geht. Sie bringen die Uhr zu einem anerkannten, hochgeschätzten und über jeden Zweifel erhabenen Experten für und dieser zückt einen riesigen Vorschlaghammer und sagt Ihnen: "Keine Sorge, ein Schlag mit diesem Vorschlaghammer auf Ihre Uhr und sie geht wieder ganz genau." Würde Sie ihm das glauben?
Nun, tatsächlich ist es nicht absolut unmöglich, dass der Vorschlaghammer das Problem behebt. Aber sehr wahrscheinlich ist es nicht. Genau so verhält es sich mit der Wirkung von ionisierender Strahlung: Natürlich ist es nicht absolut unmöglich, dass ihre extrem zerstörerische und auch hoch mutagene Wirkung zu Mutationen führen könnte und die Zelle das auch noch irgendwie überlebt. Aber wahrscheinlich ist es nicht.
Und dies beweist uns die Realität jeden Tag aufs neue, z. B. in Tschernobyl oder in Hiroshima. So ergaben die längjährige Forschungen der "Radiation Effects Research Foundation" [10] der Universität Hiroshima bei ca. 80.000 Kinder die nach den Atombombenexplosionen gezeugt und geboren wurden, das zwar die Krebserkrankungsrate leicht erhöht ist, die Mutations- bzw. Missbildungsraten aber nicht. Was eigentlich zu erwarten gewesen wäre, wenn Strahlung hauptsächlich mutagen wirkt.
Ähnliches kann man auch in Tschernobyl beobachten. Keine dreiäugigen Fische, keine Schlangen mit zwei Köpfen und auch keine Riesenregenwürmer bevölkern heute die Umgebung von Tschernobyl. Die Mutations- und Missbildungsrate in der Tierwelt in und um Tschernobyl ist vergleichbar mit der von unbelasteten Gebieten. Aber eine frühere Sterblichkeit in der Tierwelt, u. a. durch Krebs, ist scheinbar gegeben. Und dies ist kaum erklärbar, wenn denn Krebs und Missbildungen gleichermaßen aufgrund von zufälligen, ungerichteten Mutationen entstehen. Denn dann, müsste eine mutagene Noxe, wie z. B. Strahlung, auch die Häufigkeit anderer zufälliger, ungerichteter Mutationen (z. B. Fehlbildungen, Erbkrankheiten, etc.) deutlich erhöhen und nicht nur die Häufigkeit von Krebs. Aber in der Realität ist das eben nicht der Fall. Der Grund ist simple:
Wenn es 1 Milliarde mal wahrscheinlicher ist, dass eine Mutation zum Tod der Zelle statt zur einer manifesten Mutation führt, dann hat eine mutagene Noxe in der Realität kein erhöhte Zellmutation zur Folge, sondern nur eine erhöhte oder frühere Zellsterblichkeit.
Doch die meisten Karzinogene wirken nicht mal mutagen, wie z. B. Asbest. Betrachten wir Asbest, eines der wohl bekanntesten und am besten erforschten Karzinogene, dann ist es eigentlich unerklärlich, wie diese Faser bei 30% der Betroffen in der Lunge zu Krebs führen kann, wenn die Ursache dafür Mutationen sind. Wohlgemerkt mehrere, gezielte Mutationen.
Asbest an sich ist in keiner Art und Weise mutagen, aber zytotoxisch. Die zytotoxische Wirkung entsteht dadurch, dass Asbestfasern einer bestimmten Form und Größe einerseits nicht aus dem Körper ausgeschieden aber andererseits auch nicht von den Zellen (durch Umhüllung) vollständig isoliert werden können und die Spitze solcher Fasern daher immer wieder Zellen durchdringen und dabei in allen Bereichen der betroffenen Zellmatrix Zerstörung hervorrufen: Am Zellgerüst, an den Organellen, an der Kernhülle und ja, manchmal auch an DNA. Dann aber fast immer großflächig über die gesamte DNA verteilt. Was alles, wenn es nicht sowieso sofort zur mechanischen Vernichtung der Zelle führt, spätestens über die Apoptose oder Nekrose maximal letale Auswirkungen auf die Zelle haben müsste.
D. h. Asbest hat ausschließlich eine zytotoxische Wirkung. Wie viele Stoffe von denen wir wissen, dass sie krebsauslösend sind. Dies ist auch den den meisten Vertretern der Krebs-Multimutationstheorie bewusst, weshalb für solche nicht-mutagenen Karzinogene "passende" Zusatzhypothesen entwickelt wurden, die trotzdem eine Mutagenität erklären sollen. So wird z. B. die Mutagenität von Asbest (und vielen anderen, nur zytotoxischen, Karzinogenen) damit erklärt, dass die Fasern zu ständigen Entzündungsprozessen führen und diese Prozesse bei den nachfolgenden Zellen über Fehler der DNA-Reparatur und andere Gegebenheiten Mutationen auslösen.
Mal abgesehen davon das einige Karzinogene weder zytotoxisch noch mutagen sind und daher auch keine Entzündungsreaktion hervorrufen und abgesehen davon, dass die Entzündungsreaktion in erster Linie selber eine zytotoxische Wirkung ist und zudem eine Entzündung oft nur nur anfänglich existiert und es später zu einer Homöostase oder chronischen Entwicklung kommt und eine weitergehende Entzündung unterbleibt, muss man feststellen:
Es ist unglaubwürdig, dass zufällige, ungerichtete Entzündungsreaktionen mehrere ebenfalls zufällige, ungerichtete Mutationen in einer einzigen Zelle hervorrufen, die dann auch noch genau die Gene mutieren lassen die Krebs erzeugen.
Und das im Falle von Asbest bei 30% der Betroffenen.
Es macht hier keinen Sinn weiter darauf einzugehen, da es den Rahmen des Artikels sprengen würde, aber Fakt ist: Die Vertreter der Multimutationstheorie verdrehen bezüglich der Karzinogene die Realität. Obwohl schon alleine wegen der DNA-Reparatur/Apoptose bestenfalls in einem von einer Milliarde Fällen eine Mutation möglich ist, d. h. die mutagene Wirkung in der Regel eine zytotoxische Wirkung ist, ignorieren die Vertreter der Krebs-Mutationstheorie nicht nur diese Tatsache, sondern drehen das ganz auch noch um und deuten die zytotoxische Wirkungen der Mehrzahl der Karzinogene mit unreflektierten Zusatzhypothesen in eine mutagene Wirkung um.
Das ist ein typischer Konjunktions-Effekt der Urteilsheuristik, wie er in der Krebs-Multimutationstheorie zuhauf anzutreffen ist: Der unwahrscheinlichere Vorgang (Mutation führt zur Entzündung, was wiederum bestimmte andere, zufällige Vorgänge auslöst, die dann irgendwie gezielt ein proteincodiertes Gen treffen sollen) wird gegenüber dem wahrscheinlicheren Vorgang (Mutation löst Apoptose und Zelltod aus) als einzig wahrer oder als der wahrscheinlichere Vorgang definiert und als scheinbar sicheres Axiom manifestiert.
Die Kausalzusammenhänge der Karzinogene
Da fast ein Drittel alle Menschen an Krebs sterben und vermutlich die Hälfte aller Menschen im Laufe eines Lebens an Krebs erkranken (ohne Berücksichtigung der Säuglingssterblichkeit), kann der Kausalzusammenhang der Karzinogene nicht durch Zufall entstehen, sondern muss immer zwangsläufig auftreten. Und, wenn die Karzinogene Auslöser von Krebs sind, dann müssen sie einen gemeinsamen Kausalzusammenhang aufweisen. Die Frage die wir uns als Erstes stellen müssen lautet daher: Was haben alle Karzinogene gemeinsam (=Kausalnexus)? Betrachten wir unter dieser Prämisse alle Karzinogene noch einmal bezüglich ihrer Wirkungen stellen wir folgende Wirkungen fest:
A. Zyotoxisch (und das gilt auch für mutagene Noxen)
B. Zellvermehrend
C. Abnahme an teilungsfähigen Zellen (Karzinogen: Alter)
Womit auch ein erster gemeinsamer Kausalszusammenhang deutlich wird: Erhöhte Proliferation. D. h. eine (abnorm) erhöhte Proliferation ist der erste, gemeinsame Kausalzusammenhang der Karzinogene. Machen wir die Gegenprobe:
1. Im Labor werden Zellen gezüchtet, indem man ihnen Nahrung und Wachstumsfaktoren ununterbrochen zuführt und sie ständig subkultiviert. Es kommt zu einer deutlichen, abnorm erhöhten Zellvermehrung. Was eine erhöhte Proliferation bedingt.
2. Karzinogene Viren und Bakterien (HPV, Epstein-Barr, etc.) oder andere Partikel sind ausschließlich solche, die nach einer Infektion vom Immunsystem bezüglich ihrer wahrnehmbaren pathogenen Wirkung eingedämmt aber nicht restlos aus dem Körper eliminiert werden können. Diese Partikel zerstören (fatalerweise gemeinsam mit dem sie ständig bekämpfenden Immunsystem) auch nach ihrer Eindämmung in einem kleinen Bereich des Körpers tagtäglich Zellen. Es kommt zu einem ständigen, erhöhten Zellverlust. Was eine erhöhte Proliferation bedingt.
3. Asbestfasern sind zytotoxisch. Die Zytotoxität besteht dauerhaft, da die Fasern nicht isoliert oder aus der Lunge abtransportiert werden können. Es kommt zu einem ständigen Zellverlust. Und damit zu einer erhöhten Proliferation.
4. Das Tabakrauch großflächig jeden Tag eine große Anzahl Zellen zerstört muss hier nicht weiter ausgeführt werden. Es kommt zu einem kontinuierlich hohen Zellverlust. Und damit zu einer erhöhten Proliferation.
5. Übermäßige Nahrungsaufnahme führt zu Adipositas und einem ständigen Wachstum der Zellen und damit zu einem verstärkten Verlust der Zellkontakthemmung bzw. Zelldichte. Es kommt zur abnorm erhöhten Zellvermehrung. Und damit zu einer erhöhten Proliferation.
6. Mit jede Lebensalter differenzieren immer mehr teilungsfähige, somatische Zellen aus und die Anzahl der nicht-regenerativen Reservezellen und ES-Progenitorzellen verringert sich. Damit verteilt sich schon der physiologische Zellverlust im Alter auf immer weniger teilungsfähige Zellen und führt schließlich zu einer erhöhten Proliferation bei den noch vorhandenen, teilungsfähigen Zellen.
7. Gardner-Syndrom: Der vererbte Gendefekt, der dem Gardner Syndrom zugrunde liegt, schaltet die Missmatch-Reparatur und damit einen wichtigen Teil der DNA-Reparatur ab. Von Geburt an. Dies führt später vermehrt zu Krebs, hauptsächlich Darmkrebs. Dieser Gendefekt führt nicht zu weiteren Mutationen, sondern dazu, dass die Apoptose (und Nekrose) viel häufiger zum Einsatz kommt, als evolutionär vorgesehen, weil eben die DNA-Reparatur nicht mehr so effizient arbeitet. D. h. auch dieser Gendefekt bewirkt in erster Linie nicht mehr Mutationen, sondern häufiger den Zelltod. Was wiederum zu einer erhöhten Proliferation führt.
8. RB1-Gendefekt: Je nachdem Phosphorylierungsstatus und der Freisetzung von E2F unterdrückt die Mutation von pRb zwar die Tumorsuppressorwirkung von pRb/E2F führt aber gleichzeitig aufgrund der entgegengesetzten Wirkung des E2F zur Apoptose. Oder aber dass, mutierte pRb führt zu einer verstärkten Repression und darüber zum Stop der Zellteilung und letztlich auch zu einer verstärkten Apoptose/Nekrose. D. h. Die Hauptwirkung von RB1-Gendefekten ist stets die Auslösung der Apoptose bzw. Nekrose (bei Zellarrest). Was zu einer erhöhten Proliferation führt [11] [12].
Was für (7) und (8) gilt, trifft im übrigen auch für alle anderen Gendefekte zu, die mit Krebserkrankungen in Verbindung gebracht werden: Alle diese Gendefekte führen nicht zu mehr Mutationen, sondern real betrachtet zu einer erhöhten Proliferation im Gewebe.
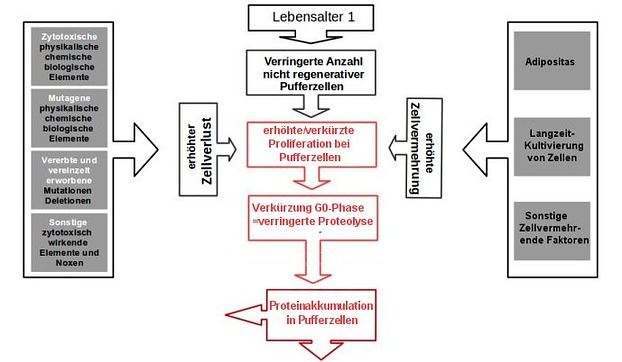
Desweiteren führt eine erhöhte Proliferation zwangsläufig zu einer verkürzten G0-Phase, da ja die erhöhte Proliferation irgendwie von den Zellen als Leistung erbracht werden muss. Natürlich dauert dies einige Zeit, da anfangs in einem Körper die Anzahl der teilungsfähigen Zellen verschwenderisch hoch ist. Weshalb Krebs in jungen Jahren auch sehr selten auftritt. Doch wenn der Einfluss der Karzinogene immer weiter anhält, dann differenzieren immer mehr Zellen aus und der Vorrat an nicht regenerativen, teilungsfähigen Zellen (z. B. ES-Progenitorzellen oder Basalzellen) nimmt immer stärker ab. Bis die Zellen irgendwann dazu gezwungen sind, die erhöhte Proliferation auf Kosten einer immer kürzer werdenden G0-Phase aufrecht zu erhalten.
In der G0-Phase erfüllt eine Eukaryotenzellen stets ihre Aufgaben und Funktionen in der Zellmatrix und sei es nur Stütz-, Füll- oder Barriere-Funktion. Und dafür, aber auch zum Schutz der Zelle oder für die erste Zeit des Wachstums, werden in der G0-Phase auch die meisten Proteine abgebaut. Vor allem überschüssige Proteine der Zellzyklusphasen G1 bis M und hier im besonderen Cyclin-D-CDK4,6. Wird die G0-Phase aber nun aufgrund einer erhöhten Proliferation verkürzt, muss die Proteolyse dieser Proteine (häufig über das Autophagosom) unterbleiben. Was zwangsläufig zu einer Proteinakkumulation und Proteinoxidation bzw. -aggregation in den Zellen führt. D. h. alle Karzinogene haben letztendlich die gemeinsamen Kausalzusammenhänge:
Erhöhte Proliferation -> Verkürzte G0-Phase -> verminderte Proteolyse der überschüssigen Zellzyklusproteine -> Proteinakkumulation (Proteinoxidation / Proteinaggregation).
Zur Katastrophe für den Organismus wird dies aber erst, wenn die immortalen Stammzellen betroffen sind.
Die Kausalzusammenhänge der Karzinogene (Bild: Thomas Wascher)
PATH - Zusammenfassung
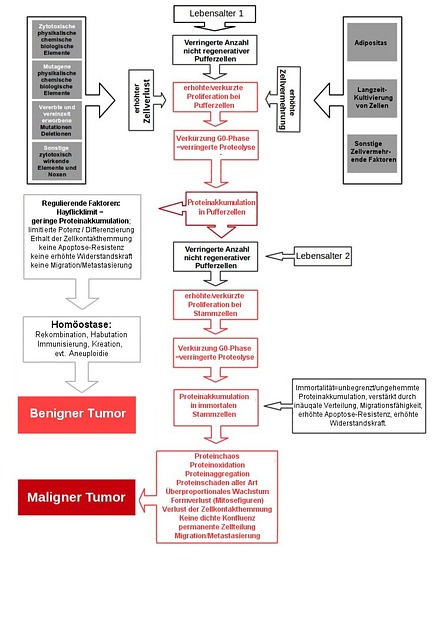
I. Das Leben an sich, aber vor allem Karzinogene, führen immer irgendwann zu einer erhöhten Proliferation. Entweder über einen pathologischen Zellverlust, eine ungewöhnlich starke Zellvermehrung oder über den physiologischen (und mehr noch über den pathologischen) Verlust an Pufferzellen (hayflicklimitierte, teilungsfähige Zellen wie Reservezellen, somatische Zellen oder Progenitorzellen) über die Lebensjahre hinweg.
II. Diese erhöhte Proliferation kann irgendwann nur noch über eine immer stärkere Verkürzung der G0-Phase erreicht werden. Eine Verkürzung der G0-Phase führt aber zwangsläufig zu einer verminderten Proteolyse, vor allem von überschüssigen Zellzyklusproteinen. Und damit zu einer Proteinakkumulation der Zellzyklusproteine (insbesondere Cyclin-D-CDK4,6) in den Zellen.
III. Solange die erhöhte Proliferation und damit letztlich die Proteinakkumulation nur bei den Pufferzellen (=teilungsfähige, aber "hayflick-limitierte" und nicht regenerative Zellen wie normale Köperzellen, Basal-/Reserve-Zellen und ES-Progenitorzellen) stattfindet, verhindern vor allem das Hayflicklimit aber auch andere fehlende Eigenschaften von Pufferzellen die fatale Auswirkung einer solchen Proteinakkumulation. Doch irgendwann reicht die hohe Anzahl von Pufferzellen alleine nicht mehr aus, um die ständig erhöhte Proliferation abzufangen. Die immortalen Stammzellen müssen nun immer häufiger eingreifen und für Zellersatz sorgen.
IV. Auch bei den Stammzellen führt dies irgendwann zu einer Proteinakkumulation. Bei den immortalen Stammzellen wird die Proteinakkumulation allerdings nicht durch ein Hayflicklimit begrenzt. Die Proteinakkumulation in den immortalen Stammzellen bedingt in der ersten Phase, dass immer mehr Proteine und Proteinarten in der Zelle akkumulieren und zu Beginn zu einem Proteinchaos führen, weil Proteine die exprimiert werden müssten, gleichzeitig abgebaut werden (oder umgekehrt). Dies führt letztlich u. a. zu Stressreaktionen in der Zelle.
V. Reaktive Stressprozesse führen wiederum zur bekannten und des öfteren beschriebenen Proteinoxidation und damit zu ersten Schäden an den Proteinen. In großem Umfang an zahlreichen Proteinarten und deren Proteinkopien. Letzteres bedingt schließlich auch eine Proteinaggregation, was die Schäden und die Menge der beschädigten Proteine erhöht. D. h. nach einer gewissen Zeit liegen bei 400 bis 800 Proteinarten und vielen Millionen Proteinkopien Schäden vor. Die Proteine können ihre Aufgabe/Funktionen nicht mehr erfüllen.
VI. Durch die geschädigten Proteine zeigt die Zelle nun ein polymorphes Verhalten und eine verändertes Differenzierungsmuster im Sinne einer Krebszelle. Gleichzeitig führt die ausgeprägte Toxizität der Proteinaggregation zu einer fast immer auftretenden Aneuploidie.
VII. Die Proteinakkumulation und ihre Folgen bedingen nach und nach aber auch ein immer stärker werdendes, abnormales Größenwachstum und ein abweichende Morphologie der Zelle. Die Zelle wird Übergroß und zeigt ungewöhnliche Mitosefiguren nach der Zellteilung.
VIII. Diese beiden Umstände von VII führen dazu, dass die proteinakkumulierten Zellen immer häufiger die Konfluenz der Zellmatrix stören. Es kommt zu einer Auflockerung der Zellkontakthemmung (die bei immortalen Stammzellen sowieso eine geringere Affinität aufweist) in der gesamten Zellmatrix und damit zu einer vermehrten Zellteilung der Zellen. Die sich immer weiter verstärkt, je länger der Zustand anhält. Die Neoplasie wächst und wächst.
IX. Die Zellen verhalten sich nun durch die hohe Anzahl an beschädigten Proteinen wie mutierte Zellen. Die immortalen Stammzellen teilen und vermehren sich immer weiter, was zu einem Auswanderungsdruck (Metastasierung) führen kann. Diese Form der Migration ist bei immortalen Stammzellen aufgrund ihrer erhöhten Apoptose-Resistenz und ihrer verstärkten Widerstandskraft gegen äußere Einflüsse im Gegensatz zu der Migration/Metastasierung von "normalen" Zellen wesentlich wahrscheinlicher. Maligner Krebs ist entstanden.
X. Über einen erhöhten Grundumsatz aufgrund der starken Zellvermehrung und der damit verbundenen Auszehrung, aber auch weil die immortalen Stammzellen die Zellen in der Zellmatrix nun durch proteinakkumulierte Tochterzellen ersetzt, was zur Zerstörung von Gewebe oder Organen führt, stirbt der Organismus schließlich. Ohne das eine einzige Mutation von Nöten gewesen wäre.
PATH - Gesamtübersicht (Bild: Thomas Wascher)
Fazit
Krebs entsteht nicht durch Veränderungen an den Genen, sondern durch Veränderungen an den Proteinen.
Es ist möglich, dass Karzinogene die Gene verändern und dadurch auch veränderte, fehlfunktioniernde Proteine exprimiert werden. Aber das ist kompliziert und unwahrscheinlich. Viel einfacher und wahrscheinlicher ist es, dass die Karzinogene die Proteine direkt beschädigen. Und dies aufgrund von Proteinakkumulation, Proteinoxidation und Proteinaggregation im großen Umfang bei vielen Proteinarten und Proteinkopien gleichzeitig.
Mutation ist unwahrscheinlich und unheilbar, PATH ist wahrscheinlich und heilbar
Heilung von Krebs
Aus PATH ergeben sich zwei wichtige Erkenntnisse. Die erste Erkenntnis:
Wenn PATH zutrifft ist Krebs heilbar oder kann zumindest in seinen letalen Auswirkungen maximal verhindert werden.
Kurzum: Niemand müsste mehr an Krebs sterben. Die zweite, aber nicht minder wichtige Erkenntnis:
Wenn PATH zutrifft, dann haben wir Krebs bisher in weiten Teilen "falsch herum" behandelt.
Zwar ist auch bei PATH die Operation das Mittel der ersten Wahl. Aber die Behandlung von Krebs mit zytotoxischen Mitteln und Behandlungsansätzen (auch Bestrahlung) wären dann ein Kunstfehler. Da dies letztlich den Krebs nur promotet.
Wenn PATH zutrifft, dann sind Behandlungsansätze die
-Krebszellen hungern lassen bzw. in die G0-Phase und damit zur Autophagozytose zwingen,
-die den Abbau bestimmter Proteine über Mono-Ubiquitine verstärken
-und die vor allem Cyclin-D-CDK4,6 in Krebszellen inhibieren und/oder degradieren
die entscheidenden Behandlungsansätze und könnten Krebs heilen, verhindern oder zumindest in seiner letalen Auswirkung maximal behindern.
Aber alle diese Behandlungansätze müsste über Jahre, eventuell ein Leben lang, aufrecht erhalten werden. Würde uns das gelingen, würde Krebs vermutlich nicht mehr zum Tod führen. Und wenn PATH zutreffen würde, dann könnte man zudem Krebs vorbeugen, u. U. mit so einfachen Mitteln wie Aspirin [23] [24].
Schlusswort
Es gibt viele Fakten und auch Forschungsergebnisse die darauf hinweisen, dass diese Hypothese zutreffen könnte und wenn sie zutrifft, dann bedeutet dies nicht mehr und nicht weniger als dass wir Krebs besiegen können.
PATH schreibt einiges bei der Krebsentstehung um. So ist z. B. bei PATH Krebs nicht die Ursache für die erhöhte Proliferation der Zellen, sondern die erhöhte Proliferation der Zellen (aufgrund von Karzinogenen) die Ursache für Krebs. Und die unzähligen veränderten Proteine sind nicht die Auswirkungen von unzähligen Mutationen an den Genen, sondern die Auswirkungen der direkten Schädigung von Proteinen durch Proteinakkumulation, Proteinoxidation und -aggregation.
Dennoch: nichts von dem was PATH beschreibt ist neu. Die Annahmen
1. dass Proteinakkumulation eine Ursache für Krebs sein könnte [13] [14] [15]
2. oder die Annahmen, dass die Cycline [16] [17] [18]
3. oder das Ubiquitin-Proteasom-System [19] [20]
4. oder die Autophagozytose [nachzulesen bei allen Arbeiten von Ohsumi]
5. oder die G0-Phase [21] [22]
einen Einfluss auf die Krebsentstehung haben müssten, sind alles bereits bekannte Informationen. D.h. vieles, fast alles, was PATH wiedergibt, wurde bereits in der Wissenschaft beschrieben. Es wurden nur noch nie zu einer gemeinsamen Hypothese zusammengefasst bzw. bis heute nicht die richtigen Schlüsse daraus gezogen.
Das dies nie geschehen ist liegt sicher auch in dem dogmatischen Status der Multimutationstheorien begründet. Und das ist vielleicht das wichtigste an dieser Arbeit: Sie können PATH anzweifeln. Sie können nach Fehlern in dieser Hypothese suchen und vielleicht, wahrscheinlich, habe ich nicht alles bedacht und es gelingt ihnen. Und vielleicht ist PATH auch falsch. Aber eines ist sicher:
Die Krebs-Multimutationstheorie und ihre Derivate sind ptolomäische Syndrome. Sie waren deshalb bis heute nicht zielführend und haben uns von der Heilung von Krebs fern gehalten. Und werden es weiterhin, wenn wir uns nicht von Ihnen lösen.
Literaturhinweise
[1] Lh1: Krebsinformationsdienst, 2017, https://www.krebsinformationsdienst.de/grundlagen/krebsstatistiken.php
[2] Said S, Dissertation "Krebserkrankungen bei rechtsmedizinischen Sektionsfällen (Hamburg 1994 bis 2001) - Retrospektive Analyse unter forensischen und epidemiologischen Aspekten", Universität Hamburg, 2005
[3] Wagner M, Dissertation "Maligne Tumoren als Zufallsbefunde bei klinischen Obduktionen - Eine retrospektive Untersuchung am Obduktionsgut des Institutes für Pathologie des Universitäts- klinikums Leipzig", Universität Leipzig, 2013
[4] Rosche W A, Foster P L, "Determining Mutation Rates in Bacterial Populations", Methods Enzymology, 2000
[5] Rosche W A, Foster P L, "Methods for Determining Spontaneous Mutation Rates", Methods Enzymology, 2006
[6] John W. Drake, Brian Charlesworth, Deborah Charlesworth and James F. Crow, "Rates of Spontaneous Mutation", Genetics, 1198
[7] Rich T, Allen RL, Wyllie AH, "Defying death after DNA damage", Nature, 2000
[8] Xiaosheng Wang, "An Exploration of Mutation Status of Cancer Genes in Breast Cancer", Journal of Next Generation Journal of Next Generation Sequencing & Applications, 2014
[9] Peter Duesberg, "Das Chaos in den Chromosomen", Spektrum der Wissenschaft, Ausgabe Oktober 2007
[10] Schull W J, "The children of atomic bomb survivors: a synopsis", Journal of Radiological Protection, 2003
[11] Vivette D. Brown, Robert A. Phillips and Brenda L. Gallie, University of Toronto, "Cumulative Effect of Phosphorylation of pRb on Regulation of E2F Activity", 1999, http://mcb.asm.org/content/19/5/3246.full
[12] Indovina P, Pentimalli F, Casini N, Immacolata Vocca, Giordano A, "RB1 dual role in proliferation and apoptosis: Cell fate control and implications for cancer therapy", 2015, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4627222/
[13] Yilmaz I A, Akçay T, Cakatay U, Telci A, Ataus S, Yalçin V, "Relation between bladder cancer and protein oxidation", International Urology and Nephrology, 2003
[14] Yongsheng Ma, Lin Zhang, Shengzhong Rong, Hongyan Qu, Yannan Zhang, Dong Chang, Hongzhi Pan, Wenbo Wang, "Relation between Gastric Cancer and Protein Oxidation, DNA Damage, and Lipid Peroxidation", Oxid Med Cell Longev., 2013
[15] Vinod Chandran, Anitha M, Avinash SS, Gayathri M Rao, Beena V Shetty, Sudha K "Protein oxidation: A potential cause of hypoalbuminemia in oral cancer", Allied Academics, 2011
[16] Shi X, Li H, Shi A, Yao H, Ke K, Dong C, Zhu Y, Qin Y, Ding Y, He YH, Liu X, Li L, Lei L, Hai Q, Chen W, Leung KS, Wong MH, Kung HF, Lin MC, "Discovery of rafoxanide as a dual CDK4/6 inhibitor for the treatment of skin cancer", Oncology Reports, Juni 2018
[17] Shanks A, Choi J, Karur V, "Dramatic response to cyclin D-dependent kinase 4/6 inhibitor in refractory poorly differentiated neuroendocrine carcinoma of the breast", Baylor University, May 2018
[18] John P. Alao, "The regulation of cyclin D1 degradation: roles in cancer development and the potential for therapeutic invention" Mol. Cancer, 2007
[19] Liu JY, Zou LP, Wu HJ, Zhao ZH, Zhang ZG, "Effects of ubiquitin-specific proteases 2-69 on proliferation of breast cancer cells", Chinese Journal of Pathology, 2018
[20] Jens Dannull, N. Rebecca Haley, Gary Archer, Smita Nair, David Boczkowski, Mark Harper, Nicole De Rosa, Nancy Pickett, Paul J. Mosca, James Burchette, Maria A. Selim, Duane A. Mitchell, John Sampson, Douglas S. Tyler, and Scott K. Pruitt, "Melanoma immunotherapy using mature DCs expressing the constitutive proteasome", IJournal of Clinical Investigation 123, S. 3135, 2013
[21] Liu JD, Wang YJ, Chen CH, Yu CF, Chen LC, Lin JK, Liang YC, Lin SY, Ho YS, "Molecular mechanisms of G0/G1 cell-cycle arrest and apoptosis induced by terfenadine in human cancer cells", Molecular Carcinogenesis, 2003
[22] Sabine Grösch, Irmgard Tegeder, Ellen Niederberger, Lutz Bräutigam, Gerd Geisslinger, "COX-2 independent induction of cell cycle arrest and apoptosis in colon cancer cells by the selective COX-2", The FASB Journal, 2001
[23] Okada S, Morimoto T, Ogawa H, Sakuma M, Matsumoto C, Soejima H, Nakayama M, Doi N, Jinnouchi H, Waki M, Masuda I, Saito Y, "Effect of Aspirin on Cancer Chemoprevention in Japanese Patients With Type 2 Diabetes: 10-Year Observational Follow-up of a Randomized Controlled Trial", Diabetes Care, 2018
[24] US Preventiv Services, Task Force, Draft Recommendation Statement, "Aspirin Use to Prevent Cardiovascular Disease and Colorectal Cancer: Preventive Medication", 2015, https://www.uspreventiveservicestaskforce.org/Page/Document/draft-recommendation-statement/aspirin-to-prevent-cardiovascular-disease-and-cancer
Über den Autor
Thomas Wascher, geb. 1965 in Bonn. Langjähriger Informatiker u. a. bei DHL und beim Deutschen Akademischen Austauschdienst (DAAD). Seit 2012 Medizinstudent, z. Zt. Universität Bonn, Anschrift: Konstantinstr. 135, 53179 Bonn. Email: [email protected]
Bildquelle:
EmbryoScope am Kinderwunschzentrum Ulm
(Schwanger werden! Interview mit dem Leiter des Kinderwunschzentrums...)